Η θεωρία στο άρθρο αυτό προέρχεται από την ενότητα 2.1.4 του βιβλίου «Γενική Χημεία Γ΄ Λυκείου Θετικής Κατεύθυνσης» - Κ. Καλαματιανός. Λεπτομερής παρουσίαση του βιβλίου, αποσπάσματά του και τρόποι αγοράς δίνονται στον ιστότοπο:

Το βιβλίο διατίθεται στα παρακάτω βιβλιοπωλεία (μεταξύ άλλων): Ιανός (Σταδίου 24, Αθήνα – Αριστοτέλους 7, Θεσ/νίκη), Κορφιάτης (Ιπποκράτους 6, Αθήνα) , Γρηγόρη (Σόλωνος 71, Αθήνα) Ελευθερουδάκης, Πατάκης, Σαββάλας-Βιβλιορυθμός (Ζωοδ. Πηγής 18 & Σόλωνος, Αθήνα), "Βιβλιοεπιλογή" Γ.Χ. Αναστασάκης (Σόλωνος 110, Αθήνα) , Βιβλιοχώρα (Χαριλάου Τρικούπη 49, Αθήνα), ΒΕΡΓΙΝΑ, ΨΑΡΑΣ (Θεσ/νίκη), ΠΑΙΔΕΙΑ (Κανάρη 11, Λάρισα).
Μέχρι τώρα έχουμε εξηγήσει με αρκετή λεπτομέρεια τα παρακάτω:
- Τι λέμε pH ενός διαλύματος (τον ορισμό του)
- Πώς υπολογίζεται το pH ενός διαλύματος
- Πώς μπορεί να «κρατηθεί» σχετικά σταθερό το pH ενός διαλύματος (χρήση ρυθμιστικού διαλύματος)
Υπάρχουν δύο βασικοί τρόποι:
- Χρήση δεικτών οξέων-βάσεων
- Χρήση πεχαμέτρου
Οι δείκτες οξέων-βάσεων είναι συνήθως ασθενή οργανικά οξέα ή ασθενείς οργανικές βάσεις και έχουν την ιδιότητα να εμφανίζουν διαφορετικό χρώμα ανάλογα με το pH του διαλύματος μέσα στο οποίο βρίσκονται.
Πώς προετοιμάζονται οι δείκτες στο εργαστήριο;
Συνήθως είναι στερεές ουσίες οι οποίες διαλύονται σε κατάλληλο διαλύτη (π.χ. αιθανόλη) και μερικές σταγόνες του διαλύματος που προκύπτει προστίθεται στο διάλυμα του οποίου θέλουμε κατά προσέγγιση να προσδιορίσουμε το pH. [1]
Ονομάζονται δείκτες γιατί όταν μερικές σταγόνες του διαλύματος τους προστίθενται σε ένα διάλυμα το χρώμα που παίρνει το διάλυμα δείχνει κατά προσέγγιση το pH του.
Ο δείκτης είναι ένα ασθενές οξύ ή μία ασθενής βάση που στην μη ιοντισμένη μορφή του έχει διαφορετικό χρώμα από ότι στην ιοντισμένη μορφή του. Για παράδειγμα εάν ο ιοντισμός του δείκτη παρασταθεί με την εξίσωση:
ΗΔ + H2O 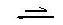 Δ- + H3O+ [2.20]
Δ- + H3O+ [2.20]
τότε στην μη ιοντισμένη μορφή του (ΗΔ) έχει άλλο χρώμα (π.χ. κίτρινο) από ότι στην ιοντισμένη μορφή του (Δ-) (που π.χ έχει κόκκινο χρώμα). Με σταδιακή προσθήκη οξέος η ισορροπία [2.20] μετατοπίζεται προς τα αριστερά οπότε το κίτρινο χρώμα επικρατεί στο διάλυμα. Αντίθετα, με προσθήκη βάσης η ισορροπία μετατοπίζεται προς τα δεξιά οπότε το κόκκινο χρώμα επικρατεί.
Για να προσδιορισθεί η περιοχή αλλαγής χρώματος του δείκτη αρκεί να γραφεί η εξίσωση των Ηenderson-Hasselbach για την περίπτωσή του:
pH = pka + log [Δ-] / [HΔ] [2.21]
Πειραματικά αποδεικνύεται ότι όταν 90% ή περισσότερο από τον δείκτη βρίσκεται ως ΗΔ (δηλαδή όταν [Δ-] / [HΔ] ≈ 0,1) τότε το χρώμα του ΗΔ επικρατεί στο διάλυμα και έτσι εμφανίζεται κίτρινο. Εάν 90% ή περισσότερο από τον δείκτη βρίσκεται ως Δ- (δηλαδή όταν [Δ-] / [HΔ] ≈ 10) τότε το χρώμα του Δ- επικρατεί στο διάλυμα και έτσι εμφανίζεται κόκκινο. Αντικαθιστώντας τους παραπάνω λόγους στην εξίσωση των Ηenderson-Hasselbach βρίσκεται η περιοχή pH όπου αλλάζει χρώμα ο δείκτης:
pH = pka + log [Δ-] / [HΔ] = pka + log(0,1) = pka – 1 [2.22]
και pH = pka + log [Δ-] / [HΔ] = pka + log(10) = pka + 1 [2.23]
Όταν [Δ-] = [HΔ] τότε pH = pka και το χρώμα του δείκτη είναι ένα «μείγμα» κίτρινου και κόκκινου δηλαδή εμφανίζεται να έχει πορτοκαλί χρώμα.
Aπό τις σχέσεις [2.22] και [2.23] προκύπτει ότι ο δείκτης αλλάζει χρώμα μεταξύ δύο μονάδων pH (όταν το pH είναι μεταξύ των τιμών pka + 1 και pka - 1).
Αν pH < pka – 1, τότε επικρατεί το χρώμα του ΗΔ (μη ιοντισμένη μορφή)
Αν pH > pka + 1, τότε επικρατεί το χρώμα του Δ- (ιοντισμένη μορφή)
Αν pH = pka τότε το χρώμα είναι ένα «μείγμα» του χρώματος του ΗΔ και του Δ-.
Στο video που δίνεται παρακάτω παρουσιάζεται η μεταβολή στο χρώμα ενός δείκτη καθώς το pH του διαλύματος μέσα στο οποίο βρίσκεται μεταβάλεται από ουδέτερο (pH του απεσταγμένου νερού) σε αλκαλικό και κατόπιν από αλκαλικό σε όξινο:
Αν pH > pka + 1, τότε επικρατεί το χρώμα του Δ- (ιοντισμένη μορφή)
Αν pH = pka τότε το χρώμα είναι ένα «μείγμα» του χρώματος του ΗΔ και του Δ-.
Στο video που δίνεται παρακάτω παρουσιάζεται η μεταβολή στο χρώμα ενός δείκτη καθώς το pH του διαλύματος μέσα στο οποίο βρίσκεται μεταβάλεται από ουδέτερο (pH του απεσταγμένου νερού) σε αλκαλικό και κατόπιν από αλκαλικό σε όξινο:
[1] Δείκτες υπάρχουν όμως σήμερα και σε μορφή χαρτιού (γνωστό ως πεχαμετρικό χαρτί). Το χαρτί εμποτίζεται κατάλληλα με ένα ή περισσότερους δείκτες επιτρέποντας έτσι να προσδιορίζεται το pH σε μεγάλο εύρος. Οταν τοποθετηθεί το πεχαμετρικό χαρτί μέσα σε διάλυμα του οποίου θέλουμε να βρούμε το pH ο συνδυασμός των χρωμάτων που παίρνουν οι δείκτες στο χαρτί συγκρίνεται με κατάλληλο πίνακα συνδυασμού χρωμάτων και pH. Το παρακάτω video είναι αρκετά διαφωτιστικό:
Δεν υπάρχουν σχόλια:
Δημοσίευση σχολίου